Читать книгу Fachbegriffe der Chemie - Michael Wächter - Страница 12
На сайте Литреса книга снята с продажи.
Alkali- und Erdalkalimetalle
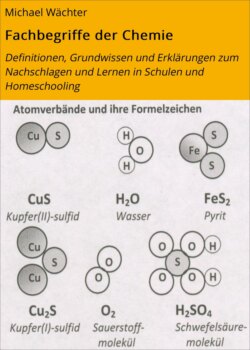
Оглавление1 Verbindungen sind chemisch zerlegbare Reinstoffe, keine Stoffgemische.
Hinweis: Zu den Stoffgemischen gehören z.B. Emulsinen, Suspensionen und Aerosole: Eine Emulsion ist ein Stoffgemenge aus zwei nicht mischbaren Flüssigkeiten (z.B. Öl in Wasser). Eine Suspension ist ein Stoffgemenge / eine Aufschlämmung von unlöslichem Feststoff in einer Flüssigkeit. Ein Aerosol ist ein Stoffgemisch von Flüssigkeit in Gas (z.B. Nebel), ein Kolloid ist eine Aufschlämmung von Feststoff in Flüssigkeit, die sich ohne Ausflockung nicht filtrieren lässt.
1 Das Zerlegen von Verbindungen (Analyse) ist deshalb immer eine chemische Reaktion – im Unterschied zu Aggregatzustandsänderungen und zu den Stofftrennverfahren, bei denen Stoffgemische in Reinstoffe aufgetrennt werden. Abbildung: Eine Magnettrommel trennt magnetisierbare Stoffe von nichtmagnetischem Material – ein Stofftrennverfahren (ganz ohne Stoffumwandlung / chemische Zerlegung!) Bildquelle: Maettchy, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=1031666
Hinweis: Zu den Stofftrennverfahren gehören Filtration, Destillation und Extraktion. Aggregatzustandsänderungen sind Erstarren (Gefrieren), Sieden, Sublimieren und Kondensieren.
Definitionen dazu: Kondensation ist der Übergang vom gasförmigen zum flüssigen Aggregatzustand, Sublimation ist der Übergang vom festen zum gasförmigen Aggregatzustand. Eine Filtration ist ein Stofftrennverfahren zur Abtrennung unlöslicher Feststoffe aus einer Flüssigkeit (Suspension). Eine Destillation ist ein Stofftrennverfahren zur Auftrennung eines Flüssigkeiten-Gemisches durch Erhitzen über den Siedepunkt der flüchtigeren Substanz mit anschließender Kondensation zur Abtrennung derselben („Destillat“; ein Azeotrop ist ein durch Destillation nicht weiter auftrennbares Flüssigkeitsgemisch). Eine Extraktion ist ein Stofftrennverfahren zur Auftrennung eines Feststoffgemisches, bei dem dessen lösliche Bestandteile durch eine Flüssigkeit (Extraktionsmittels) abgetrennt werden („Extrakt“, „Auszug“). Eine Sedimentation ist die Bildung eines Niederschlages („Ausfällung“) aus einer Suspension, indem der unlösliche Feststoff (das „Sediment“) schwerkraftbedingt absinkt, sich unten absetzt.
1 Die Elemente werden in Haupt- und Nebengruppen eingeteilt. Vier wichtige Hauptgruppen sind:1: Alkalimetalle, 2: Erdalkalimetalle 7: Halogene 8: Edelgase Metalle stehen im Periodensystem links und unten, Nichtmetalle oben und rechts.
2 Die 1. Hauptgruppe im Periodensystem sind die Alkalimetalle (ohne Wasserstoff in „Vorperiode“, von arab. „al kalja“ = Asche, aus Asche u. ähnl. herstellbar), 2. Hauptgruppe: Erdalkalimetalle (Oxide „erdig“). Sie alle sind metallisch (Leichtmetalle), sehr empfindlich (unedel) und brennbar. Sie reagierenmit Luftsauerstoff (O2) zu Oxiden (Anion O2-)und mit Wasser zu Laugen (Hydroxiden, Anion OH-) und Wasserstoffgas (H2).
Beispiele: 4 Li + O2 → 2 Li2O (aus Li+ und O2- 2:1) 2 Mg + O2 → 2 MgO (aus Mg2+ + O2- 1:1) 2 Li + 2 H2O → 2 LiOH + H2 (Li+/OH-) Mg + 2 H2O → 2 Mg(OH)2 (aus Mg2+ / OH- 1:2)
1 Die Oxide der Alkali- und Erdalkalimetalle bilden in Wasser Laugen (das sind Lösungen der Hydroxide in Wasser, pH > 7; Laugen sind „basisch“, also Lösungen von Basen in Wasser, Wortherkunft von: „die Basis von Salzen“). Beispiele:Li2O + H2O → 2 LiOH Mg + 2 H2O → Mg(OH)2
2 Laugen (Basen) reagieren mit Säuren zu Salz und Wasser („Neutralisation“).Salze sind also Verbindungen von Metallen mit Nichtmetallenund entstehen aus der Reaktion von Laugen mit Säuren zu Salz und Wasser (Neutralisation): Lauge + Säure → Salz + Wasser Beispiele: NaOH + HCl → NaCl + H2O Natronlauge + Salzsäure → Natriumchlorid + Wasser Mg(OH)2 + 2 HCl → MgCl2 + 2 H2O Magnesiumhydroxid + Salzsäure → Magnesiumchlorid + Wasser
3 Erdalkalimetalle reagieren nicht ganz so heftig wie Alkalimetalle. Alkalimetall-Salze sind wasserlöslich. Bei den Erdalkalisalzensind Hydroxide kaum und Carbonate und Sulfate überhaupt nicht wasserlöslich (Ausnahme: MgSO4). Beispiele: Löslich sind NaCl, KCl, LiOH, KOH, Na2S, Na2SO4, MgSO4usw., unlöslich sind: CaSO4 (Gips), SrSO4, BaSO4, CaCO3 (Kalk), SrCO3, BaCO3, Ca(OH)2 (kaum lösl.)
4 Alkali- und Erdalkali-Atome (außer Mg) nehmen in Flammen Energie auf (Absorption) und geben sie als Licht(-energie) wieder ab (Emission). Das Licht kommt, wenn nach außen „angehobene“ Außenelektronen in der Atomhülle wieder „zurückspringen“.
Abb.: Feuerwerk mit Flammfärbung durch Emission (eig. Foto)