Читать книгу Fachbegriffe der Chemie - Michael Wächter - Страница 16
На сайте Литреса книга снята с продажи.
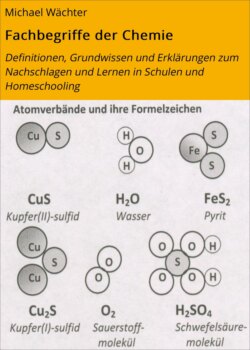
Grundwissen zu Komplexen und ihren koordinativen Bindungen
Оглавление1 Komplexe entstehen durch den Austausch von Elektronenpaaren zwischen einem Zentralatom und einem oder mehreren Liganden, die sich geometrisch um das Zentralatom herum anordnen (Koordination).
Abb.: Komplexe sind oft farbig – Lösungen komplexer Verbindungen(eig. Foto)
1 Zentralatome sind Kationen oder Metallatome mit freier, innerer „Elektronenlücke (zumeist Nebengruppenelemente, diese haben freie 3d- und 4dOrbitale), Beispiele:Cu2+, Ag+, Fe2+, Fe3+, Cr3+, Co2+, Ni2+, aber auch Ni, Pb2+, Bi3+ u.a.
1 Liganden sind Moleküle oder Anionen, die freie Elektronenpaare zur Verfügung stellen können.
Beispiele:NH3 (Name als Ligand: -ammin-), H2O (-aquo-), CO (-carbonyl-), NO (-nitrosyl-), F-, Cl-, Br-, I- (-fluoro-, -chloro- usw.), CN-, SCN- (-cyano-, -thiocyano-) , OH- (-hydroxo-), O2- (-oxo-), S2- (-thio- / -sulfo-), S2O22- (-thiosulfato-) usw., aber auch große Moleküle wie EDTA, Eiweiße u.a.
Ethylendiamin (ED) Dimethylglyoxim (DMG)
Auch die Verbindungen Ethylendiamin (links, am Stickstoffatom sitzt jeweils ein freies Elektronenpaar) und D i m ethyl g lyoxim ( DMG , rechts, hier sitzen freie Elektronenpaare an den beiden Stickstoffatomen) sind gute Komplexbildner. DMG bindet sich z.B. an Ni 2+ -Ionen (himbeerroter Niederschlag von Nickel-DMG):
Das Molekül der Verbindung Ethylendiamintetraacetat (EDTA, "Komplexon") weist sogar 6 Koordinationsstellen auf, mit denen es über jeweils ein freies Elektronenpaar ein Metall-Kation binden kann (an jedem der vier negativ geladenen O-Atome und an jedem der zwei N-Atome):
1 Komplexe weisen koordinative Bindungen auf („höherer Ordnung“, nicht ionisch!) und werden in Formeln durch eckige Klammern dargestellt (Zentralatom vorne, Liganden in Klammern). Beispiele:Cu2+ + 2 Cl- CuCl2 (eine „normale“ ionische Bindung entsteht, ein Salz), aber:CuCl2 (gelöst) + 2 Cl-[Cu(Cl)4]2- (eine koordinative Bindung wird gebildet: Cu2+ + 4 Cl-[Cu(Cl)4]2-, neongrün ).
Ähnlich bilden Kupfer(II)-ionen auch mit Wassermolekülen (!) und mit Ammoniakmolekülen (II) farbige Komplexe:
(I) CuSO4 (fest, trocken farblos) + 4 H2O [Cu(H2O)4]2+ (hellblauer Komplex) + SO42- Kupfer(II)-sulfat (weiß) + Wasser Tetraquokupfer(II)-Komplex + Sulfat-Anion (gelöst) (II) Cu2+ + 4 NH3[Cu(NH3)4]2+ (tiefblau, koordinative Bindung).
1 Komplexe reagieren anders als freie Ionen. Ihre Reaktionsform ist derLiganden-Austausch.
Beispiele: Cu2+ + Fe → Cu + Fe2+ (Redox), aber: [Cu(NH3)4]2+ + Fe zeigen keine Reaktion!
[Cu(NH3)4]2+ (tiefblau, pH >7) + 4 Cl- [Cu(Cl)4]2-(hellgrün) + 4 NH3
[Cu(H2O)4]2+ (hellblau, pH <7) + 4 Cl- [Cu(Cl)4]2- (hellgrün) + 4 H2O
[Cu(H2O)4]2+ (hellblau, pH <7) + 4 NH3 [Cu(NH3)4]2+ (tiefblau, pH >7) + 4 H2O
CuSO4 (farblos, fest, trocken) + 4 H2O [Cu(H2O)4]2+ (hellblau)
1 Komplexe sind oft farbig, weil die Elektronen über den ganzen Komplex verteilt werden und deshalb mit Licht(teilchen) in Wechselwirkung treten können. Ihre Bildung eignet sich gut für Nachweisreaktionen.
Beispiele: [Cu(NH3)4]2+ (tiefblau) [Cu(H2O)4]2+ (hellblau) [Cu(Cl)4]2- (hellgrün) [Bi(I)4]- (orange) [Fe(NO)(H2O)5]2+ (braun) [Fe(CN)6]4- (rot) [Fe(H2O)6]2+ (schwach grünlich) [Fe(SCN)3] (blutrot, verdünnt orangegelb) H[Co(SCN)4] (in Amylalkohol blau) Nickel-DMG (himbeerrot, vgl. Merksatz 104).
Hinweis:Komplexe sind in der Chemie oft bedeutsame Farb- und Naturstoffe oder auch Katalysatoren.Chlorophyll (Blattgrün, ein Magnesiumkomplex) und Hämoglobin (der rote Blutfarbstoff, ein Eisen-Komplex) sind z.B. wichtige Komplexe (Biochemie). Ausnahmsweise farblose Komplexe sind: [Fe(F)6]3-, [Ag(NH3)2]+, [Ag(S2O3)2]3-, [Zn(OH)4]2-, [Al(OH)4]- u.a.
1 Die Namen von Komplexen werden bei Kationen aus den Zahlsilben, den Liganden- und den Metallnamen mit Ladungszahl gebildet. Bei den anionischen Komplexen geht man bei Metallen von lateinischen Namen aus und setzt die Endung –at (wie bei Anionen).Beispiele:[Cu(NH3)4]2+ Tetramminkupfer(II)-Komplex[Cu(Cl)4]2- Tetrachlorokuprat(II)-Komplex[Ag(NH3)2]+ Diamminsilber(I)-Komplex [Ag(S2O3)2]3- Dithiosulfatoargentat(I)-Komplex[Fe(CN)6]4- Hexacyanoferrat(II)-Komplex[Fe(CN)6]3- Hexacyanoferrat(III)-Komplex[Bi(I)4]-. Tetraiodobismutat(III)-Komplex [Fe(NO)(H2O)5]2+ Pentaquonitrosyleisen(II)-K.
2 Die geometrische Struktur der Komplexe richtet sich oft nach dem Zentralatom (der Anordnung / Koordination von Liganden um das Zentralatom): Bei zwei „einzähnigen“ Liganden (Koordinationszahl = 2) ist der Komplex linear, bei Koordinationszahl 4 tetraedrisch oder quadratisch-planar, bei Koordinationszahl 6 ist er oktaedrisch.Beispiele: [Ag(NH3)2]+linear, [Fe(F)6]4-oktaedrisch,
Ni(Cl)42-tetraedrisch,Ni(CN)64-oktaedrisch
[Fe(CN)6]4-ebenfalls oktaedrisch cis/trans-Formen
Bildquellen: Tetrachloroniccolat-Komplex: Von Leyo - Eigenes Werk, Gemeinfrei, https://commons.wikimedia.org/w/index.php?curid=8467529, Hexacyanoniccolat-Komplex: Philnate, über: https://commons.wikimedia.org/wiki/File:CisoktaKomplex.svg (ebenf. gemeinfrei)