Читать книгу Fachbegriffe der Chemie - Michael Wächter - Страница 9
На сайте Литреса книга снята с продажи.
Namen und Formeln chemischer Verbindungen
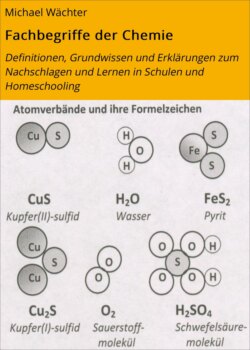
Оглавление1 Namen von Salzen aus zwei Elementen bestehen aus dem Metall-Name, ggf. mit Ionenladung, dem Nichtmetall-Namen (oft in lateinischer Form) und der Endung –id Beispiele: Magnesiumoxid MgO, Natriumchlorid NaCl, Natriumoxid Na2O, Kupfer(I)-sulfid Cu2S, Kupfer(II)-sulfid CuS,Eisen(III)-oxid Fe2O3
Achtung: Wenn Sauerstoff als drittes Element hinzukommt und sich mit dem Nichtmetall verbindet, dann endet der Name auf –at.
Beispiele: Natriumsulfat Na2SO4, Kalziumcarbonat CaCO3
1 Namen von molekularen Verbindungen aus zwei Elementen werden gebildet aus dem Namen des Nichtmetalles, das im PSE weiter links oder weiter unten steht, und dem Namen des zweiten Nichtmetalles (im PSE weiter rechts oder oben). Davor kommt jeweils eine Zahlsilbe für das Mengenverhältnis (siehe Formel): mono = 1, di = 2, tri = 3, tetra = 4, penta = 5, hexa = 6, hepta = 7.
Beispiele: (Mono-)Kohlen(stoff)monoxid CO (giftig!), (Mono-)Kohlen(stoff)dioxid CO2, Distickstofftrioxid N2O3, Distickstoffmonoxid N2O (Lachgas), Kohlenstofftetrachlorid CCl4, Schwefelhexafluorid SF6‘
1 Elementare Gase sind zweiatomig (Ausnahme: Edelgase), da sich ihre Atome miteinander verbinden. Beispiele: Sauerstoff O2, Chlor Cl2, Wasserstoff H2, Iod(dampf) I2, Stickstoff N2.
2 Formeln enthalten kleine, tiefgestellte Zahlen für die Anzahl der Atome im Molekül oder die Mengenverhältnisse der Ionen im Salzkristall. Man bildet sie aus den Namen der Verbindungen nach oben genannten Regeln: Elementsymbole für die Element-Namen einsetzen und kleine, tiefgestellte Zahlen für die Stoffmengenverhältnisse der Elemente in dieser Verbindung. Hinweis: Dabei müssen Ionenladungen in Salzen immer ausgeglichen werden (Gesamtladung Null), denn Kationen und Anionen bilden nur neutrale Salzkristalle. Beispiel: Al2O3 (aus 2 Al3+und 3 O2-, kgV = 6)
| Abbildungen:Über die Atomzahlenverhältnisse in den Atomverbänden und die Formeln sind Vergleiche der Masse der Atome möglich. So kommt man auf die Größen „Masse“ und „Stoffmenge“ (vgl. Grundgesetze der Chemie, Kapitel 3, undv Grundwissen zur Physikalischen Chemie, Kap. 13; Bildquelle: eig. Werk). |
1 Reaktionsgleichungen geben die (Formeln der) Ausgangsstoffe und (der) Endstoffe wieder.Große Zahlen geben Stoffmengenverhältnisse an, also dass man mehrere Teilchen bestimmter Stoffe (Formeln) braucht.
Beispiel:Bei der Knallgasreaktion (Merksatz Nr. ) verbinden sich Wasserstoff H2und Sauerstoff O2 im Volumen- und Stoffmengenverhältnis 2 : 1zu Wasserdampf H2O: Wasserstoff + Sauerstoff Wasser(stoffoxid) Aus zwei Litern Wasserstoffgas und 1 Liter Sauerstoffgas werden nach der Explosion und Abkühlung (ohne Kondensation zu flüssigem Wasser) ziemlich genau zwei Liter Wasserdampf.Die Reaktionsgleichung in Formeln ist: 2 H2 + O2 2 H2O (und nicht: 2 H2 + O2 H2O).
Diese Gleichung2 H2 + O2 2 H2O sagt aus: 2 Mol H2 + 1 Mol O2 2 Mol H2O 2 Liter H2-Gas + 1 Liter O2-Gas 2 Liter H2O-Dampf (Gas)2 Moleküle H2 + 1 Molekül O2 2 Moleküle H2O
In ähnlichem Stoffmengenverhältnis reagieren z.B. auch Kupfer Cu und Schwefel S zu Kupfer(I)-sulfid CuS: 2 Mol Cu + 1 Mol S 1 Mol Cu2S. Hier entsteht jedoch nur 1 Mol Produkt – und nicht zwei Moleküle wie bei der Knallgasreaktion. Daraus folgerte der Chemiker Avogadro, dass elementare Gase zweiatomig vorkommen (molekular) – so entdeckte er die „Moleküle“ (vgl. folgende Seite: Gleiche Volumina an Gasen enthalten gleiche Stoffmengen bzw. Anzahlen an Molekülen!).
Erinnerung: Dieses folgt u.a. aus den vorherigen Grundsätzen:Wenn sich Stoffe umwandeln, so reagieren sie chemisch. Chemische Reaktionen sind Vorgänge, bei denen mindestens ein neuer Stoff entsteht (erkennbar an neu auftretenden Stoffeigenschaften). Reaktionsgleichungen geben die (Formeln der) Ausgangsstoffe und (der) Endstoffe wieder.
Elemente bestehen aus Atomen (kleinstmögliche Stoffportionen der Elemente). Bei Reaktionen bilden sie Verbindungen (Teilchen-Umgruppierung), d.h. die Atome der Elemente bilden Atomverbände aus Ionen oder Molekülen (Verbände aus Atomen gleicher Elektronegativität bilden neutrale Verbände.
Beispiele für Moleküle und ihre Formeln: Sauerstoff O2, Chlor Cl2, Iod I2, Hexan C6H14, Schwefelpulver S8 usw.). weitere Beispiele für Reaktionsgleichungen: Kupfer + Schwefel Kupfer(II)-sulfid Cu + S CuS (Stoffmengenverhältnis Cu : S = 1:1) Kupfer + Schwefel Kupfer(I)-sulfid 2 Cu + S Cu2S (Stoffmengenverhältnis Cu : S = 2:1) Aluminium + Sauerstoff Aluminiumoxid 4 Al + 3 O2 2 Al2O3 (Verhältnis Al : O = 2 : 3)